 |  |
Самое необыкновенное вещество 
Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать,
тобой наслаждаются, не ведая, что ты такое!
Нельзя сказать, что ты
необходима для жизни: ты – сама жизнь. Ты наполняешь нас радостью, которую
не объяснить нашими чувствами...
Ты самое большое богатство на свете...
Антуан де Сент-Экзюпери Почему же одно из бесчисленных
химических соединений с простой и ничем не примечательной формулой,
состоящее из двух обычных химических элементов, молекула которого
трехатомна, – простая окись водорода, самая обычная вода, занимает столь
особое место в жизни природы? И чем же объясняется такая исключительная роль
воды? Почему вода не подчиняется законам химии? Самое изученное вещество еще
до конца так и не разгадано. Я попробую с точки зрения химии прикоснуться к
разгадкам лишь нескольких тайн. Итак, начнем со строения молекулы.
Как построена молекула воды?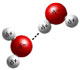
Такой вопрос может показаться не только странным, но и немного невежливым.
Кто же этого может не знать? Всякий знает, что вода – это соединение
водорода и кислорода. А какова ее формула? Правильно – Н2О. 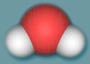 Молекула
воды не линейна. В пространстве ее можно изобразить в виде полярного
тетраэдра. Такое строение ведет к возникновению очень сильного взаимного
притяжения молекул воды друг к другу: каждая молекула воды может образовать
четыре одинаковые водородные связи с другими молекулами воды. Благодаря
возникновению таких связей и обусловлено необычность свойств этого вещества. Молекула
воды не линейна. В пространстве ее можно изобразить в виде полярного
тетраэдра. Такое строение ведет к возникновению очень сильного взаимного
притяжения молекул воды друг к другу: каждая молекула воды может образовать
четыре одинаковые водородные связи с другими молекулами воды. Благодаря
возникновению таких связей и обусловлено необычность свойств этого вещества.
Вода – универсальный растворитель Мы рассмотрели
строение воды. Оно поможет нам в раскрытии тайны – почему вода является
универсальным растворителем. Так как молекула воды полярна, она стремиться
нейтрализовать электрическое поле. На поверхности растворяемых веществ
межатомные и межмолекулярные силы слабеют в 80 раз. Такая высокая
диэлектрическая проницаемость характерна только для воды. Этим объясняется
ее способность быть универсальным растворителем. Вода –
инертный растворитель. Это важно для всего живого на земле, поскольку
необходимые питательные вещества поступают в водных растворах в сравнительно
устойчивом виде. Вода имеет память о ранее растворенных в ней веществах.
Нет в природе ничего прочнее воды. Даже гранит вода со временем разрушает,
поэтому в морской воде можно найти не только легкорастворимые вещества. Вода
морей содержит в себе почти все элементы периодической системы Менделеева.
Больше всего в морской воде поваренной соли. Поэтому вода в море соленая.
При какой температуре вода должна кипеть? Вода, исходя
из химического состава, – оксид водорода, но ее можно еще назвать гидридом
кислорода. Если проанализировать все температуры кипения гидридов, то
окажется, что вода должна кипеть при температуре ниже нуля. Вот и опять
исключение из правил – вода кипит приблизительно на сто восемьдесят градусов
выше, чем должна кипеть. При какой температуре вода
замерзает?  Не
правда ли, вопрос не менее странен, чем предыдущий? Ведь все знают, что вода
замерзает при нуле градусов? А при какой температуре вода должна замерзать в
соответствии со своей химической природой? Оказывается, гидрид кислорода на
основании его положения в таблице Менделеева должен был бы Не
правда ли, вопрос не менее странен, чем предыдущий? Ведь все знают, что вода
замерзает при нуле градусов? А при какой температуре вода должна замерзать в
соответствии со своей химической природой? Оказывается, гидрид кислорода на
основании его положения в таблице Менделеева должен был бы  затвердевать
при ста градусах ниже нуля. затвердевать
при ста градусах ниже нуля.
Повышение температур кипения
и замерзание обусловлено взаимодействием молекул воды друг с другом, то есть
водородными связями. Сколько может быть различных вод?
Чтобы ответить на этот вопрос обратимся к периодической системе Д. И.
Менделеева. И определим: сколько на свете водородов и кислородов?
В природе существует три изотопа водорода и три различных изотопа кислорода.
Самый легкий водород – 1Н (протий),
тяжелый – D (дейтерий), сверхтяжелый – Т (тритий).
Последний – радиоактивен. Эти
изотопы могут образовывать 18 разновидностей воды:
1Н216О; 1НD16О; D216О;
1НT16О; DT16О; T216О; 1Н217О;
1НD17О; D217О; 1НT17О;
DT17О; T217О; 1Н218О;
1НD18О; D218О; 1НT18О;
DT18О; T218О.  Поэтому,
вода – смесь различных молекул, неодинаковых по изотопному составу. Вода в
природе всегда различна. В каждом источнике свой изотопный состав воды. Поэтому,
вода – смесь различных молекул, неодинаковых по изотопному составу. Вода в
природе всегда различна. В каждом источнике свой изотопный состав воды.
Вода в природе не имеет постоянного состава, она вечно меняется. Как права
поговорка: "Дважды в одну и ту же реку не войдешь".
Распадаются ли в воде на ионы ее собственные молекулы?
Молекулы воды очень прочны, но все же очень небольшая часть их диссоциирует
на ионы: H2O = H+ + OH-.
Какую форму имеет вода? Мы все знаем, что вода
принимает форму сосуда, так написано в любом учебнике, но это неверно. Вода
имеет форму шара, но на земле обычно искажена силой тяжести. В этом очень
легко убедиться. В космосе вода принимает свою форму. Можно увидеть это и на
Земле, посмотрев на падающую каплю или мыльный пузырь.  
Как построена молекула льда? В структуре льда молекулы
упакованы рыхло. Казалось бы, такая упаковка частиц, должна приводить к
неустойчивости структуры. Но не тут-то было! На самом деле сетка не
разрушается, а перестраивается. В этой удивительной структурной устойчивости
состоит важнейшее свойство водородных связей между молекулами воды.
Правильное кристаллическое строение льда мы можем увидеть в изумительном
изяществе снежинок и в красоте морозных узоров на замерзших оконных стеклах.  
Для чего вода нужна человеку?  Давно
известно, что человек на 70% состоит из воды Живой организм – это огромная
лаборатория, в которой постоянно идут химические реакции и почти для всех
необходима вода. При ее недостатке замедляются все химические процессы, а
при уменьшении воды в клетках организма примерно на 20% останавливаются. Это
приводит к смерти. Без воды все живое погибает через несколько суток. Давно
известно, что человек на 70% состоит из воды Живой организм – это огромная
лаборатория, в которой постоянно идут химические реакции и почти для всех
необходима вода. При ее недостатке замедляются все химические процессы, а
при уменьшении воды в клетках организма примерно на 20% останавливаются. Это
приводит к смерти. Без воды все живое погибает через несколько суток.
Жесткость воды Жесткость, вызываемая содержанием в воде
бикарбонатов кальция и магния, называют карбонатной или временной. При
кипячении соли осаждаются и жесткость уменьшается.
Жесткость, обусловленная присутствием прочих солей кальция и магния и
сохраняющаяся после кипячения воды, называется некарбонатной или постоянной.
Ее можно удалить не только добавкой соды, но и заменив ионы кальция и магния
ионами натрия, пропустив ее через ионообменную колонку с катионитом. Ионы
кальция и магния удержатся в катионите, а в воду перейдет эквивалентное
количество ионов натрия. Общая жесткость воды
складывается из карбонатной и некарбонатной жесткости. В
жесткой воде плохо развариваются мясо, овощи, крупы, плохо заваривается чай.
При стирке тканей на поверхности волокон осаждаются нерастворимые соединения
и постепенно разрушают их. Образование накипи на стенках нагревательных
элементов приводит к преждевременному их изнашиванию.
Качество воды Качество воды определяется наличием в ней
химических элементов. К загрязнителям относятся: медь, железо, марганец,
сульфиды, фториды, соли кальция и магния, органические соединения. Если
концентрация этих элементов превышает норму, то у человека может развиться
хроническая интоксикация. Токсическое воздействие проявляется не только при
употреблении внутрь, но и при проведении гигиенических процедур, так как
вещества способны всасываться через кожу. Кстати так же
воздействует и хлор, который применяют для уничтожения микроорганизмов в
водопроводной сети. Его парами можно отравиться, поэтому не рекомендуются
длительные горячие ванны. Вода была бы полезней, если ее
не хлорировать, а озонировать или обрабатывать бактерицидными лампами.
Источники Материал подготовила
преподаватель
химии и информатики
Ивашенцева С. И. ОГОУ НПО "Профессиональное училище № 38"
с. Новая Усмань
Воронежская обл. | |  | |  | | |
Это интересно

|
Только факты | 
| 
| | 
| |
• Струя химически чистой воды сечением 1 см2
по прочности на разрыв не уступает, стали того же сечения. 
• Впервые формула воды была предложена в 1805 г.
А. Гумбольдтом и Ж. Гей-Люссаком. 
• Дейтерия в воде очень мало. На каждые 6700
атомов протия в среднем приходится только один атом дейтерия. 
• Количество трития меньше одного килограмма
на всем земном шаре, но он имеется в любой капле воды. 
• Молекулы воды очень устойчивы и распадаются
на водород и кислород лишь при температуре свыше тысячи градусов. 
• Вода служит катализатором для многих
химических процессов, в частности реакций горения некоторых веществ. 
• Один литр воды при температуре четыре
градуса выше нуля весит больше, чем такой же литр при более высокой
и более низкой температурах. 
• При потреблении газиро-ванной воды
углекислота может сильно раздражать слизистую оболочку желуд-ка, что
приводит к гастритам. Так что лучше пить негази-рованную воду. | | 
| | 
|

| | 
| |
Кристаллизационная вода Некоторые вещества имеют
способность связывать моле-кулы воды. Такие вещества называются
кристаллогидра-тами. Вода, входящая в состав кристаллов называет-ся
кристаллизационной во-дой. Например: железный купорос содержит семь
молекул воды, гипс – две, сода – десять. 
Гигроскопическая
вода Вещества, которые кажутся
совершенно сухими (песок, вата, сухая глина и т. д.)
содержат влагу. Это легко обнаружить подогрев их в сухой пробирке. На
стенках пробирки мы обнаружим капельки воды. Вода,
удерживаемая поверхностью и порами веществ, и не связанная с ними
химически, носит название гигроскопической, а вещества –
гигроскопичными. Они жадно впитывают влагу и являются хорошими
осушителями. | | 
| | 
|

| | 
| |
Городская вода В колодцах, вырытых на большую
глубину, нет взвешенных примесей, почти отсутствуют микроорганизмы.
Такая вода самая полезная. 
В больших городах вода поступает из рек или водохранилищ. Она содержит
много вредных для человека примесей и болезнетворных организмов. Поэтому
она нуждается в очистке. Воду сначала пропускают через решетки, которые
задерживают крупные предметы. Потом отстаивают, фильтруют для удаления
нерастворимых твердых частиц. Далее хлорируют. 
"Жесткая" и "мягкая" вода В воде растворены соли
кальция и магния. Если концентрация их велика, то воду называют жесткой,
если мала – мягкой. Для
повседневного использования лучше всего подходит не любая вода, а именно
мягкая, которая не содержит растворенных в ней солей (например,
дистиллированная, дождевая, снеговая). 
Очень важно при использовании воды – смяг-чить воду. Устранить
жест-кость можно фильтрованием, кипячением, добавлением химических
веществ. | | 
| | 
|

| | 
| |
Химический состав морской воды Морская вода
содержит свыше шестидесяти элементов периодической системы Д. И.
Менделеева. В ней есть: магний, кальций, сера,
бром, йод, фтор, железо, медь, никель, олово, уран, кобальт. Даже
присутствует серебро и золото, правда в незначи-тельных
количествах. | | 
| | 
|

| | 
| |
Тяжелая вода Вода, содержащая дейтерий называется
тяжелой. Она отличается от простой воды физическими и химическими
свойствами. Химические реакции с тяжелой водой
протекают медленнее, чем с обычной. Тяжелая вода применяется в качестве
замедлителя нейтронов в ядерных реакторах. | | 
| | 
|

| | 
| |
Из истории воды Платон впервые создал теорию
круговорота воды. Аристотель указал на роль
солнечного тепла в процессе испарения воды с поверхно-сти морей и
океанов, осаждение поднявшихся высоко над землей водных паров –
происхождение дож-дей. Рассмотрел источники питания рек.
Древний арабский ученый Масуди в IX в.
экспери-ментально подтвердил тео-рию Аристотеля о круго-вороте воды в
природе. Он получил пресную воду при химической перегонке морской воды. | | 
| | 
|

| |  | |  |
|